Cinetica De Orden 0
Ecuaciones de velocidad integradas. Concentración del rea ctivo.
Tema 6 Cinetica Quimica Ppt Descargar
Mecanismos de reacción ü.
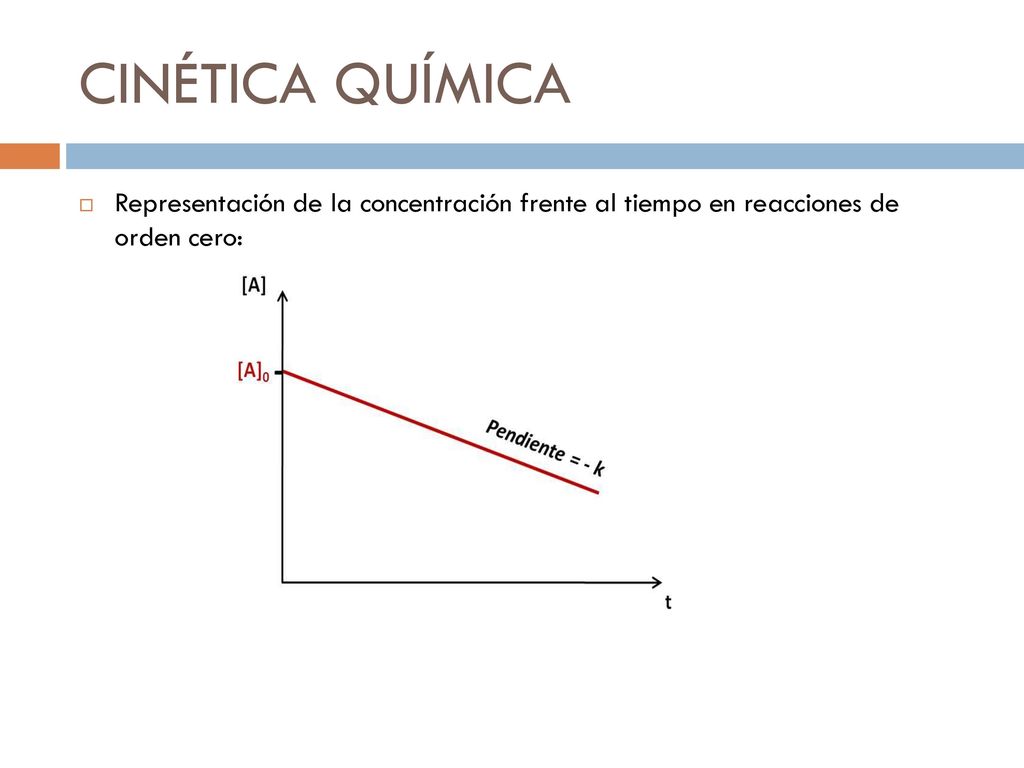
Cinetica de orden 0. Se puede escribir entonces. El orden de reacción es el factor exponencial que acompaña a la. Reacción de orden 0 Reacción de orden 1 Reacción de orden 2 Determinación experimental del orden de reacción. Cuando las concentración de A es 02 M y la de B 08 M la velocidad de formación de AB es de 56. Reacciones el orden de reacción es 0 1 2 o número fraccionario. Absorción metabolismo o excreción La representación de la c pfrente al tiempo es linear.
Ln ln 𝑜 𝑡. La reacción A B AB es de primer orden respecta a A y a B. B Cuánto valdrá la velocidad de reacción en el momento en que A 01 molesL y B 04 molesL. De forma análoga para reacciones de orden cero Ejemplos. Cinética de orden 0 La velocidad es independiente de la cantidad de fármaco que esté sufriendo el proceso eg. Es una cinética de eliminación donde comienza estando saturada de orden 0 y luego cuando la concentración del F disminuye hasta un nivel de concentración plasmática determinada pues comienza a comportarse como una cinética de orden 1 es decir exponencial que depende de la proporción de F y no de la cantidad de este.
Entrada a circulación sanguínea de. Observa que la ley de velocidad integrada tiene la forma y mx b que es la ecuación de una recta. A A 0 e ak t Fundamentos de Qu mica Grado en F sica Cin etica qu mica EneroMayo 2011 11 29. Tal y como hemos comentado el orden de reacción ha de ser determinado experimentalmente y para ello se utiliza el método de las velocidades iniciales que consiste en mantener constante la concentración de. Para orden 0 y 1 se cambia el signo de la pendiente para obtener el valor de k pendiente k - mientras que para orden 2 no se realiza este cambio pendiente k. A Calcula el valor de la K de velocidad.
Si de entrada no se conociera el orden de reacción se procede realizando los tres. Reacciones de segundo orden Concentración tiempo Vida media Concentración. Ecuaciones de las cinéticas de orden 0 1 y 2 ü. Reacciones de primer orden Ecuaciones concentración tiempo. Cinética Página -21-2 Reacción de Segundo Orden 3 Reacción de Orden Cero. V k A dA dt 𝐴𝑜 𝐴 0 𝑡 𝑡 Integrando.
Definición y factores de los que depende ü. Times Verdana Times New Roman Arial inicial MathType 60 Equation 4. Si representamos el LnA frente al tiempo obtenemos una línea recta con ordenada LnA 0 y con pendiente la constante de velocidad. 0 1 Reacción de Primer Orden. Teoría del complejo activado. A B 2A productos.
N 2 Supongamos la reacción A B productos 1er Caso. Determine el tiempo de vida media del compuesto N 2 O 5 en la siguiente reacción a 25C si la. Una reacción de orden 0 que nos dice que la concentración de A en un tiempo t es igual a menos la constante de velocidad k por t más la concentración inicial de A. B Reacciones de segundo orden. Velocidad de reacción de reacciones de orden cero con un solo reactivo. A distinto de B A B productos.
Luego la cinética es de orden dos cuando la velocidad de reacción es proporcional al cuadrado de la. La velocidad de reacción es independiente de la concentración del sustrato y por tanto la reacción es un proceso cinético de orden cero. Reacciones de primer orden La cinética de una reacción es de orden uno cuando la velocidad de conversión depende de la concentración de uno de los reactivos. Reacciones de primer orden segundo orden y orden cero Las reacciones de orden uno La ecuaci on integrada de una reacci on de orden uno en A queda ln A A 0 ak t y despejando. Como A y B varían con el tiempo para resolver la integral vamos a ponerla en. Lo anterior se re fleja en las si guientes ex presiones.
CINETICA 1- INTRODUCCIÓN El área de la química que estudia la velocidad o rapidez con la que ocurre una reacción. Ecuación de Arrhenius ü. Cinética química Contenidos Bibliografía recomendada Velocidad de reacción Velocidad de reacción.

Ecuacion Noyes Whitney Wikipedia La Enciclopedia Libre
Cinetica De Eliminacion De Farmacologia Recorda La Cinetica De Orden 0 Es Dosis Dependiente Porque Dependiendo De La Dosis Va A Variar La Velocidad De Eliminacion A Dosis Bajas No Se

Reaccion De Orden 0 1 Y 2 Qb281 Youtube

La Cinetica Quimica Y La Industria Farmaceutica

Cinetica Quimica Parte 1 Introduccion Teorica Youtube

Farmacocinetica Y Biofarmacia 2 6 Liberacion Cinetica De 0 Y 1 Orden Youtube

Modelos De Cinetica De Adsorcion De A Pseudo Primer Orden B Pseudo Download Scientific Diagram

Cinetica Quimica Presentacion Powerpoint

Enzimas Palabra Griega Zyme En Fermento Enzimas Polimeros




Posting Komentar untuk "Cinetica De Orden 0"